2020年是特别的一年,新(xīn)冠肺炎疫情席卷全球,多(duō)行业发展受到影响,但我國(guó)药品行业的发展并未就此而中断,國(guó)内药品申报稳步上升,截止12月31日,CDE受理(lǐ)的受理(lǐ)号个数达10300多(duō)个。以下為(wèi)详细年度分(fēn)析:
一、2020年药品注册申请受理(lǐ)总體(tǐ)情况
1、各药品类型申报情况
2020年CDE共承办新(xīn)的药品注册申请以受理(lǐ)号计有(yǒu)10312个(含药械组合及其他(tā)65件,以受理(lǐ)号计,数据统计截止2020年12月31日,下同),相比2019年增加了27.6%;其中化药受理(lǐ)7907个,占2020年全部注册申请受理(lǐ)总数的76.7%,相比2019年增加了22.1%;中药受理(lǐ)472个,占2020年全部注册申请受理(lǐ)量总数的4.6%;生物(wù)制品受理(lǐ)1868个;占2020年全部注册申请受理(lǐ)量总数的18.2%。2016-2020年各类药品注册申请受理(lǐ)情况详见图1。
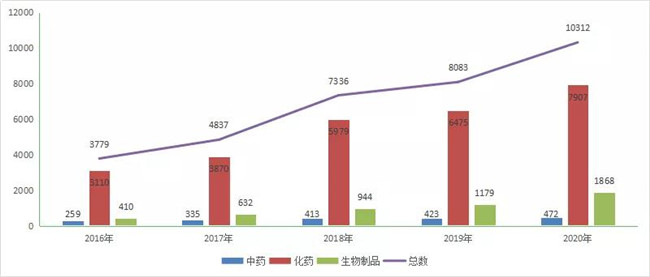
图1 2016-2020年各类药品注册申请受理(lǐ)情况
2、每月申报情况
2020后半年CDE每月受理(lǐ)数量多(duō)于前5个月每月的受理(lǐ)数量,其中6月為(wèi)峰值1149个。2020年每月受理(lǐ)情况详见图2。
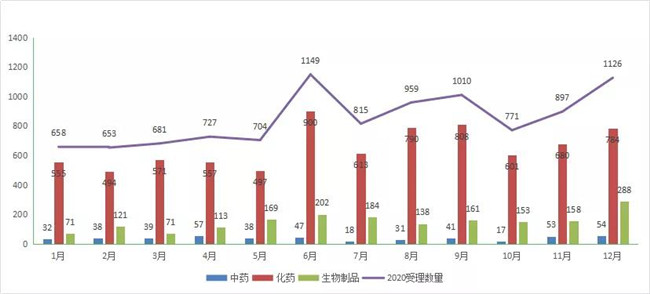
图 2 2020年每月 CDE 药品受理(lǐ)情况
3、各类申报类型总體(tǐ)情况
2020年各类申报类型為(wèi):补充申请:6384 个,占2020受理(lǐ)总量 61.9 %,报临床1650个,报生产1427个,申请再注册329个。2018-2020 年 CDE 药品各申请类型受理(lǐ)情况见图3。
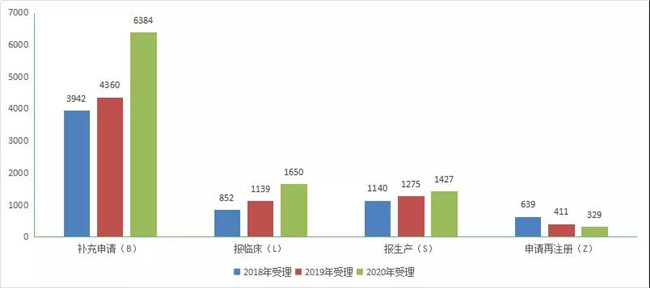
图 3 2018-2020 年 CDE 药品各申请类型受理(lǐ)情况
注:统计规则:S、L、B、Z 分(fēn)别是受理(lǐ)号第 4 位字母
4、國(guó)产创新(xīn)药受理(lǐ)情况
2020年CDE受理(lǐ)國(guó)产1类创新(xīn)药注册申请828个,其中受理(lǐ)临床申请781个,上市申请43个。按药品类型统计,化學(xué)药574个,生物(wù)制品254个。
5、进口创新(xīn)药及原研药受理(lǐ)情况
2020年CDE受理(lǐ)5.1类化學(xué)药进口原研药注册申请340个,受理(lǐ)1类进口创新(xīn)药注册申请219个。
6、2020年审评完结情况
根据药智注册与受理(lǐ)数据库最新(xīn)统计,2020年(注:状态开始日期从2020年1月1日至2020年12月31日)审评完结受理(lǐ)号数量(指CDE完成技术审评并移交审批的品种数量,办理(lǐ)状态包括在审批、待审批、审批完毕或制证完毕等状态,以受理(lǐ)号计)共计9092个,其中化药7049个,中药467个,生物(wù)制品1576个。2020 年 CDE 各药品类型审结情况详见图4。
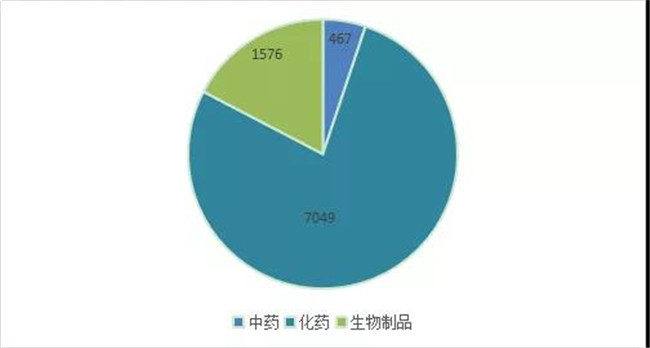
图 4 2020 年 CDE 各药品类型审结情况
7、申报地區(qū)情况
在各省市的药品申报方面,上海以1240受理(lǐ)号领先,其次依次為(wèi)江苏、北京、广东、浙江。2020年各省市申报情况见图5。
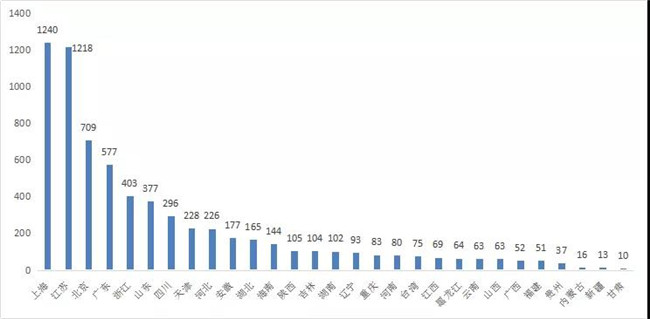
图 5 2020年各省市申报情况
以下让我们详细分(fēn)析一下化药、中药、生物(wù)制品、优先审评和突破性治疗的注册受理(lǐ)及审评情况。
二、 化药
1、2020年化药申报情况
2020 年CDE共承办新(xīn)的化药注册申请以受理(lǐ)号计有(yǒu)7907个。2020 年每月 CDE 化药受理(lǐ)情况详见图6。
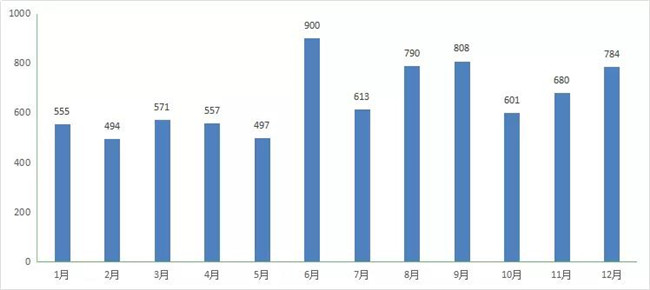
图 6 2020 年每月 CDE 化药受理(lǐ)情况
在7907个化药注册申请中,化學(xué)药IND受理(lǐ)申请948个,较2019年增長(cháng)了36.5%;受理(lǐ)化學(xué)药NDA 191个,较2019年增長(cháng)了46.9%;受理(lǐ)仿制药上市申请(ANDA)1126件,较2019年增長(cháng)了7.5%;受理(lǐ)一致性评价补充申请908个。2020年化學(xué)药各类注册申请受理(lǐ)情况详见图6。2016-2020年化學(xué)药IND申请、NDA、ANDA和一致性评价注册申请受理(lǐ)情况详见图7。
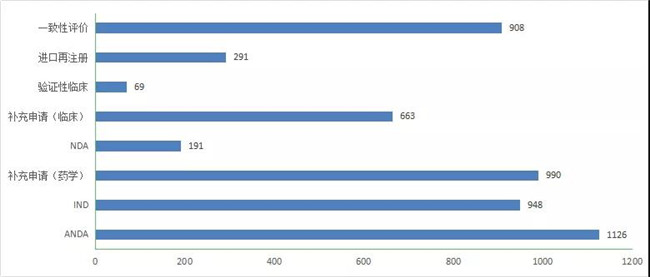
图 7 2020 年化药各类注册申请受理(lǐ)情况
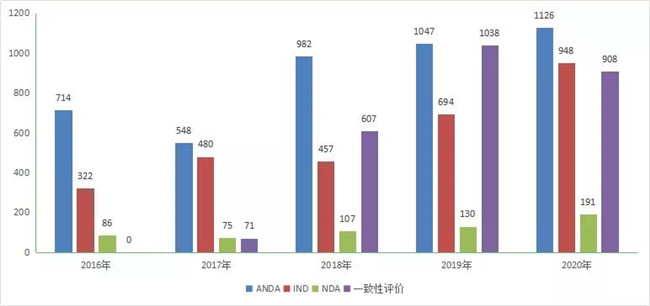
图 8 2016 - 2020 年化药各类注册申请受理(lǐ)情况
从化药申请类型看,补充申请还是占主要,2020年化药补充申请注册申报受理(lǐ)4891个,占到了化药申报总量的61.8%。2020 年 CDE 化药各申请类型受理(lǐ)情况详见图9。
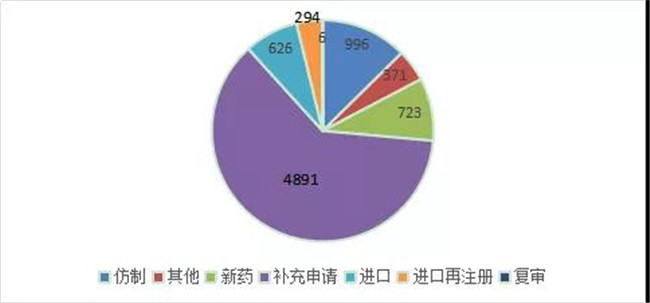
图 9 2020 年 CDE 化药各申请类型受理(lǐ)情况
1.1 化药1 类新(xīn)药申报情况
按现行化药注册分(fēn)类,化药1类定义為(wèi):境内外均未上市的创新(xīn)药,包含含有(yǒu)新(xīn)的结构明确的、具有(yǒu)药理(lǐ)作用(yòng)的化合物(wù),且具有(yǒu)临床价值的药品。2020年每月化药1 类新(xīn)药受理(lǐ)情况详见图10。
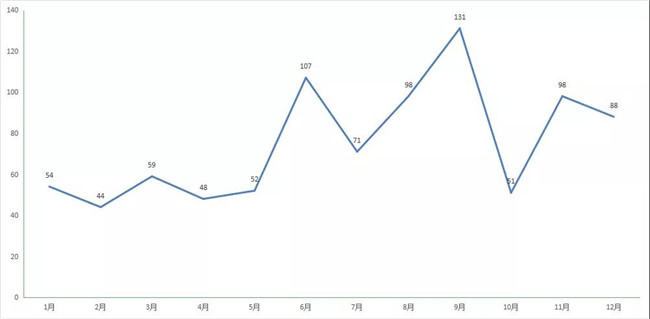
图 10 2020 年每月 CDE 化药1 类新(xīn)药受理(lǐ)情况
2020年申报1类化學(xué)药创新(xīn)药注册申请901个,较2019年增加了312个,其中受理(lǐ)IND申请721个,较2019年增長(cháng)了169个;受理(lǐ)NDA 31个,较2019年增加了10个。2020年化药1类各类注册申请受理(lǐ)情况详见图11。
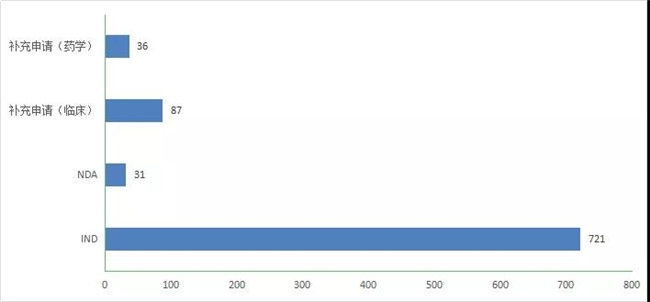
图 11 2020 年 化药1类各类注册申请受理(lǐ)情况
1.2 化药1 类新(xīn)药(國(guó)产)、进口申报情况
901个1类化學(xué)药创新(xīn)药注册申请中,國(guó)产化學(xué)药创新(xīn)药注册申请以受理(lǐ)号计有(yǒu)574个(不包含补充申请),进口化學(xué)药创新(xīn)药注册申请以受理(lǐ)号计有(yǒu)179个(不包含补充申请)。2018-2019化药1类新(xīn)药、进口注册申请受理(lǐ)情况详见图12。
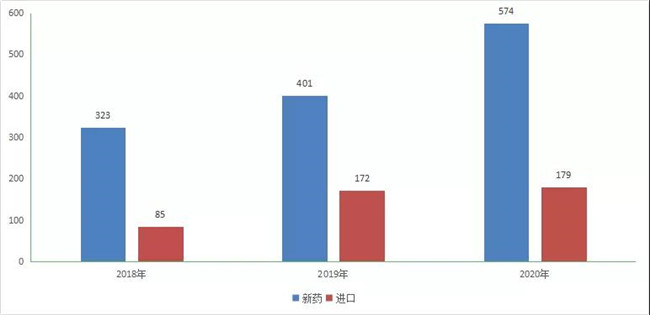
图 12 2018- 2020年化药1类新(xīn)药、进口注册申请受理(lǐ)情况
1.3 一致性评价受理(lǐ)情况
随着一致性评价的持续进行,2020年CDE受理(lǐ)一致性评价补充受理(lǐ)号908个,1月為(wèi)峰值109个。2020年每月一直性评价受理(lǐ)情况详见图13。
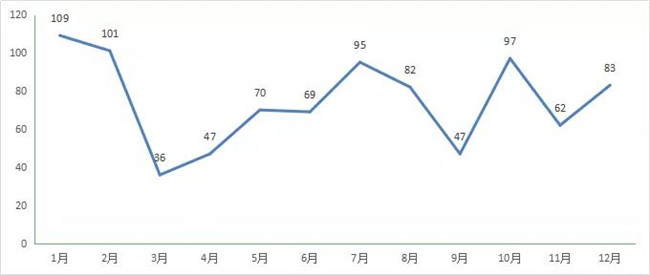
图13 2020 年每月 CDE一致性评价受理(lǐ)情况
2 、2020年化药审评完结情况
2020年(注:状态开始日期从2020年1月1日至2020年12月31日)CDE完成审评(指CDE完成技术审评并移交审批的数量,办理(lǐ)状态包括在审批、待审批、审批完毕或制证完毕等状态,以受理(lǐ)号计)的化學(xué)药注册申请7049个,其中补充申请4425个,仿制929个,新(xīn)药547个。2020年化學(xué)药各申请类型的审评完成情况详见图14。
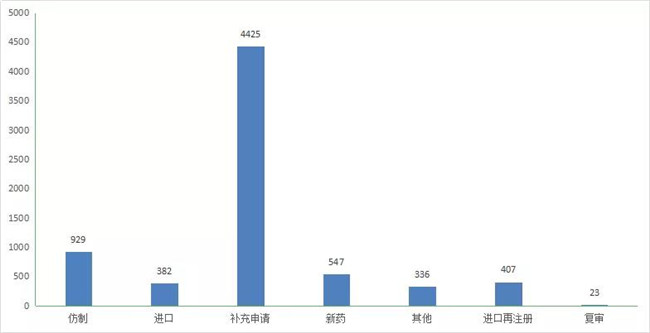
图 14 2020年化學(xué)药各申请类型的审评完成情况
2020审评结论最多(duō)的為(wèi)补充申请,其次為(wèi)批准生产,具體(tǐ)结论请查询药智网药品注册与受理(lǐ)数据库。2020 年化药审评结论情况详见图15。
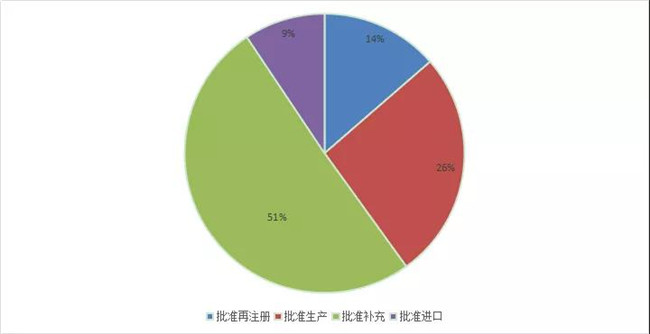
图 15 2020 年化药审评结论情况
注:统计时间為(wèi) 2020年 12 月 31 日,不同时间点统计会造成审结完成数量和审评结论数量有(yǒu)差异。
三、 中药
1、 中药申报情况
2020 年CDE共承办新(xīn)的中药注册申请以受理(lǐ)号计有(yǒu)472个。总體(tǐ)来说,中药受自身药品特性的影响,一直以来申报都处于比较低迷的状态,新(xīn)药申请较少,受理(lǐ)号主要集中在补充申请,如何改变也是值得业界思考的。2020 年每月 CDE 中药受理(lǐ)情况详见图16。
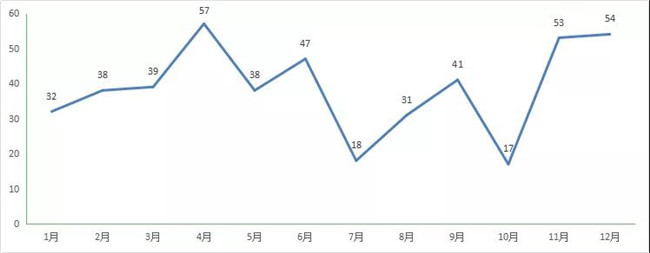
图 16 2020 年每月 CDE 中药受理(lǐ)情况
2020年CDE受理(lǐ)中药注册申请472个,其中受理(lǐ)中药IND申请22件,受理(lǐ)中药NDA 6件,受理(lǐ)中药ANDA 1件。2020年中药各类注册申请受理(lǐ)情况详见图16。2018-2020年中药IND申请、NDA和ANDA受理(lǐ)情况详见图17。
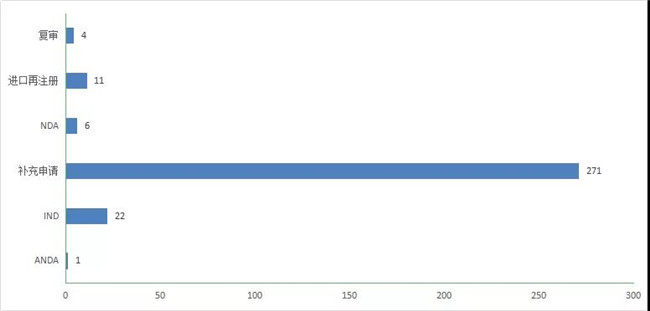
图 17 2020年中药各类注册申请受理(lǐ)情况
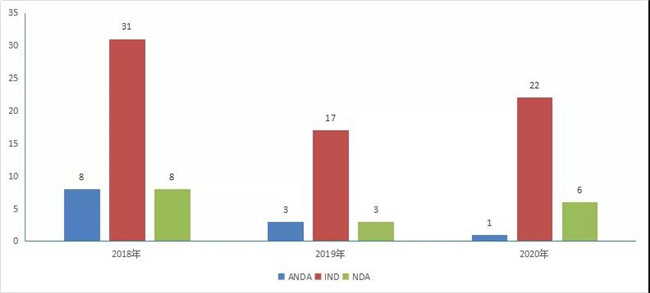
图 18 2018-2020年中药IND申请、NDA和ANDA受理(lǐ)情况
2、中药注册申请审评完成情况
2020年(注:状态开始日期从2020年1月1日至2020年12月31日)CDE完成审评(指CDE完成技术审评并移交审批的品种数量,办理(lǐ)状态包括在审批、待审批、审批完毕或制证完毕等状态,以受理(lǐ)号计)的中药注册申请467个,其中补充申请397个,新(xīn)药21个,进口在注册20个。2020年中药各申请类型的审评完成情况详见图19。
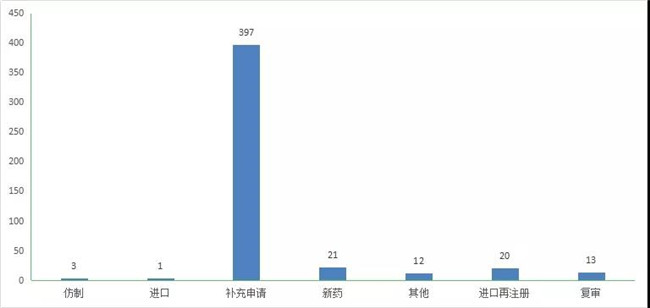
图 19 2020年中药各申请类型的审评完成情况
四、 生物(wù)制品
1、生物(wù)制品申报情况
2020 年CDE共承办新(xīn)的生物(wù)制品注册申请以受理(lǐ)号计有(yǒu)1852个。2020 年每月 CDE 生物(wù)制品受理(lǐ)情况详见图20。
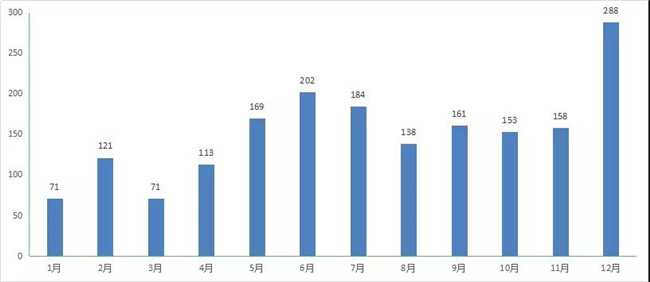
图 20 2020 年每月 CDE 生物(wù)制品受理(lǐ)情况
2020年CDE受理(lǐ)生物(wù)制品注册申请1852件,其中受理(lǐ)生物(wù)制品IND申请575个(预防用(yòng)IND申请24个,治疗用(yòng)IND申请551个);受理(lǐ)生物(wù)制品NDA申请125个(预防用(yòng)NDA 8件,治疗用(yòng)NDA 117件)。2020年生物(wù)制品各类注册申请受理(lǐ)情况详见图20。2018-2020年生物(wù)制品IND申请和NDA受理(lǐ)情况详见图21。
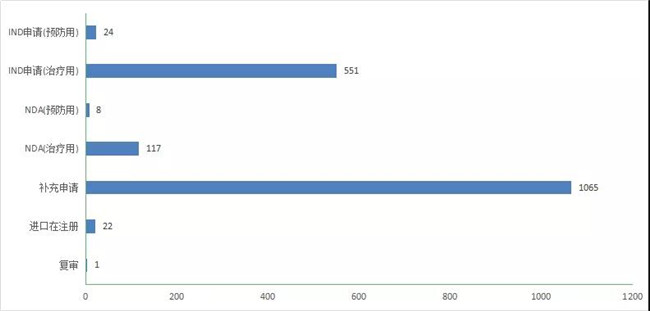
图 21 2020年生物(wù)制品各类注册申请受理(lǐ)情况
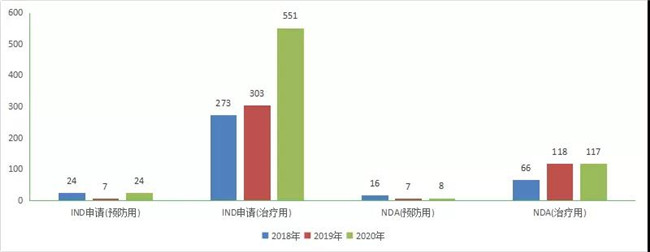
图 22 2018-2020年生物(wù)制品IND申请和NDA受理(lǐ)情况
2、1类生物(wù)制品创新(xīn)药受理(lǐ)情况
CDE受理(lǐ)1类生物(wù)制品创新(xīn)药注册申请336个,其中预防用(yòng)生物(wù)制品4个,治疗用(yòng)生物(wù)制品332个。1类生物(wù)制品创新(xīn)药注册申请中,IND申请274个,较2018年增加了153个;NDA 17个(均為(wèi)治疗用(yòng)生物(wù)制品),较2018年增加了11个。
3、 生物(wù)制品注册申请审评完成情况
2020年(注:状态开始日期从2020年1月1日至2020年12月31日)CDE完成审评(指CDE完成技术审评并移交审批的品种数量,办理(lǐ)状态包括在审批、待审批、审批完毕或制证完毕等状态,以受理(lǐ)号计)的生物(wù)制品注册申请共1576个(包含17个體(tǐ)外诊断试剂),其中完成补充申请963个,完成新(xīn)药267个,完成进口231个。2020年生物(wù)制品各申请类型的审评完成情况详见图23。
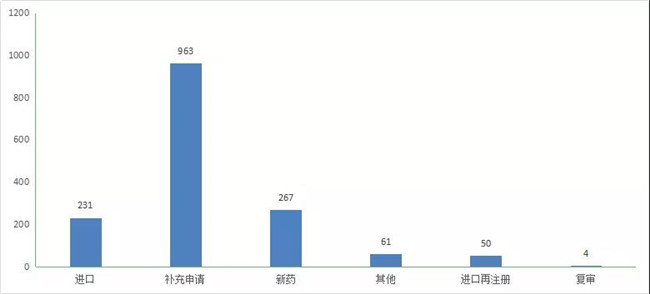
图 23 2020年生物(wù)制品各申请类型的审评完成情况
五、 优先审评品种纳入情况
2020年CDE将204个(按受理(lǐ)号计)注册申请纳入优先审评程序,较2019年减少了49个,其中儿童用(yòng)药19个、罕见病用(yòng)药22个、临床急需短缺药品15个;适应症包括:抗肿瘤、神经系统等领域。
六、 突破性治疗品种纳入情况
申请适用(yòng)突破性治疗药物(wù)程序条件:药物(wù)临床试验期间,用(yòng)于防治严重危及生命或者严重影响生存质量的疾病,且尚无有(yǒu)效防治手段或者与现有(yǒu)治疗手段相比有(yǒu)足够证据表明具有(yǒu)明显临床优势的创新(xīn)药或者改良型新(xīn)药等。
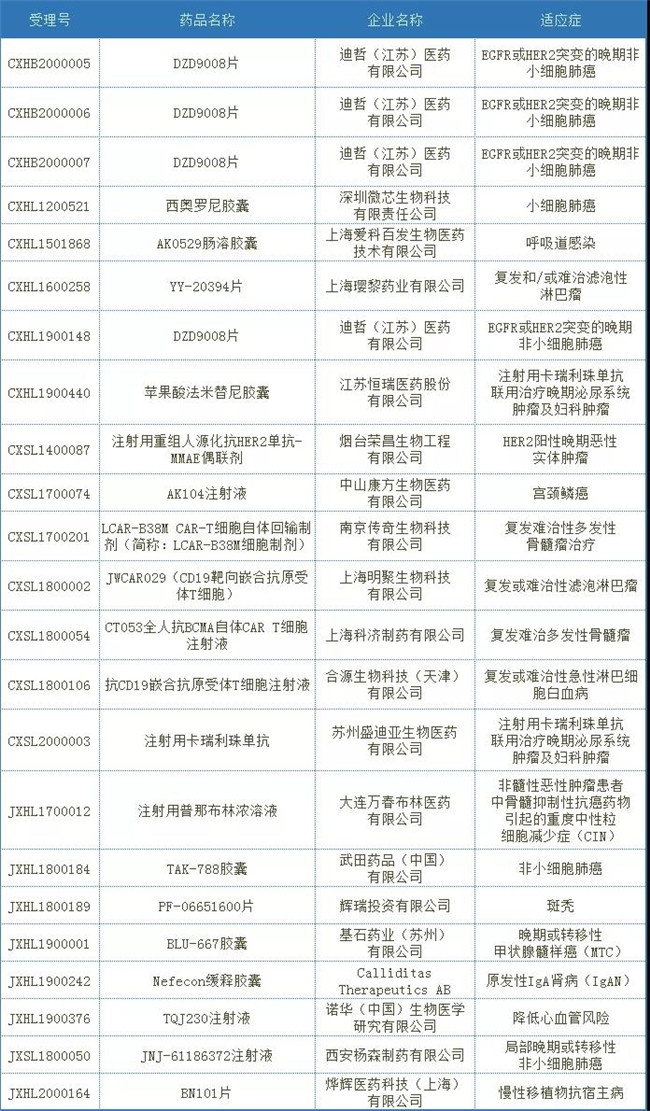
2020年CDE将23个(按受理(lǐ)号计)注册申请纳入突破性治疗品种,其中包括化药15个,生物(wù)制品8个;适应症主要集中在肿瘤癌症领域。2020年纳入破性治疗品种见表1。
表1 2020年纳入突破性治疗品种


Copyright © 2017 www.showby-bj.com 北京硕佰医药科(kē)技有(yǒu)限责任公司 版权所有(yǒu)
電(diàn)话:010-56371382(北京) 邮箱:dingh@showby-bj.com;wensm@showby-bj.com